副交感神経刺激薬とは
副交感神経刺激薬とは、副交感神経節後繊維の伝達物質であるアセチルコリンに対して影響を与えるか、アセチルコリン受容体に直接作用することで副交感神経興奮時と同じ効果を示す薬物である。
副交感神経刺激薬の分類
・コリンエステラーゼ阻害薬
副交感神経刺激薬には、自身がアセチルコリン受容体に直接的に結合して作用を示すコリン作動薬と、アセチルコリンを分解するアセチルコリンエステラーゼを阻害することでアセチルコリンの作用を増強させ作用を示すコリンエステラーゼ阻害薬の2種類が存在する。
アセチルコリン受容体の分類
ニコチン受容体
| NM受容体 | 骨格筋収縮 |
|---|---|
| NN受容体 | シナプス伝達 |
ムスカリン受容体
| M1受容体 | シナプス伝達 |
|---|---|
| M2受容体 | 心機能低下 |
| M3受容体 | 平滑筋収縮、唾液分泌促進 |
| M4受容体 | 肺 |
| M5受容体 | 大脳皮質 |
コリン作動薬
| アセチルコリン | ・神経伝達物質であるアセチルコリンを直接投与することもある ・アセチルコリンはコリンエステラーゼによりコリンと酢酸に分解されるため効果は一過性である |
|---|---|
| メタコリン | ・合成コリンエステル類 ・普通のアセチルコリンよりもコリンエステラーゼに分解されにくいため、作用は持続的である |
| カルバコール | ・合成コリンエステル類 ・普通のアセチルコリンよりもコリンエステラーゼに分解されにくいため、作用は持続的 ・ニコチン様作用あり |
| ベタネコール | ・合成コリンエステル類 ・普通のアセチルコリンよりもコリンエステラーゼに分解されにくいため、作用は持続的である ・腸管麻痺、低活動膀胱、麻痺性イレウスに適応あり |
| ムスカリン | ・天然アルカロイド(ベニテングタケに含まれる) ・キノコ中毒の原因物質 ・臨床応用はなし |
| ピロカルビン | ・天然アルカロイド(ヤボランジの葉に含まれる) ・3級アミン ・眼に対する作用(毛様体筋、瞳孔括約筋収縮作用)が強力 ・発汗作用(分泌腺からの分泌促進) ・緑内障治療において瞳孔括約筋を収縮させて縮瞳を促し、眼圧を下降させる役割で使われている。 |
| セビメリン | ・アセチルコリン類似化合物 ・唾液腺に存在するムスカリン受容体に結合し、唾液分泌作用を示す。 ・シェーグレン症候群の口腔乾燥症状に用いられる。 |
| アクラトニウム | ・アセチルコリン類似化合物 ・消化管平滑筋に存在するムスカリン受容体に結合することで消化管の運動を促進する。 ・胃酸分泌には影響を与えない。 |
| カルニチン | ・消化管機能低下による慢性胃炎に適応あり |
コリンエステラーゼ損害薬
| フィゾスチグミン | ・天然アルカロイド(カラバル豆) ・3級アミン ・血液脳関門を通過する→中枢作用あり ・以前、重症筋無力症の治療薬として用いられた。(今は臨床応用無し) ・コリンエステラーゼ阻害作用は可逆的 |
|---|---|
| ネオスチグミン | ・合成4級アミン ・(4級アミンは3級に比べて大きいため)血液脳関門を通過しない→中枢作用なし ・重症筋無力症、術後の腸管麻痺、下部尿路機能障害に適応あり ・コリンエステラーゼ阻害作用は可逆的 |
| ジスチグミン | ・合成4級アミン ・(4級アミンは3級に比べて大きいため)血液脳関門を通過しない→中枢作用なし ・重症筋無力症、術後の腸管麻痺、下部尿路機能障害に適応あり ・コリンエステラーゼ阻害作用は可逆的 |
| ピリドスチグミン | ・合成4級アミン ・(4級アミンは3級に比べて大きいため)血液脳関門を通過しない→中枢作用なし ・重症筋無力症に適応あり ・コリンエステラーゼ阻害作用は可逆的 |
| アンベノニウム | ・合成4級アミン ・(4級アミンは3級に比べて大きいため)血液脳関門を通過しない→中枢作用なし ・重症筋無力症に適応あり ・コリンエステラーゼ阻害作用は可逆的 |
| エドロホニウム | ・合成4級アミン ・(4級アミンは3級に比べて大きいため)血液脳関門を通過しない→中枢作用なし ・重症筋無力症の“診断”に用いられる ・コリンエステラーゼ阻害作用は可逆的 |
| エコチオパート | ・眼圧低下作用・コリンエステラーゼ阻害作用は不可逆的 ・臨床応用なし |
| サリン、タブン | ・有機リン化合物 ・コリンエステラーゼのエステル結合部をリン酸化する ・コリンエステラーゼ阻害作用は不可逆的 ・脂溶性が高く血液脳関門を通過する→中枢作用あり |
| マラチオン | ・有機リン化合物 ・コリンエステラーゼのエステル結合部をリン酸化する ・コリンエステラーゼ阻害作用は不可逆的 ・人では速やかに分解されるが昆虫は分解が遅いので殺虫剤として用いられる |
【プロ講師解説】このページでは『ボルタ電池(仕組み・各極の反応・分極の理由など)』について解説しています。解説は高校化学・化学基礎を扱うウェブメディア『化学のグルメ』を通じて6年間大学受験に携わるプロの化学講師が執筆します。
ボルタ電池とは
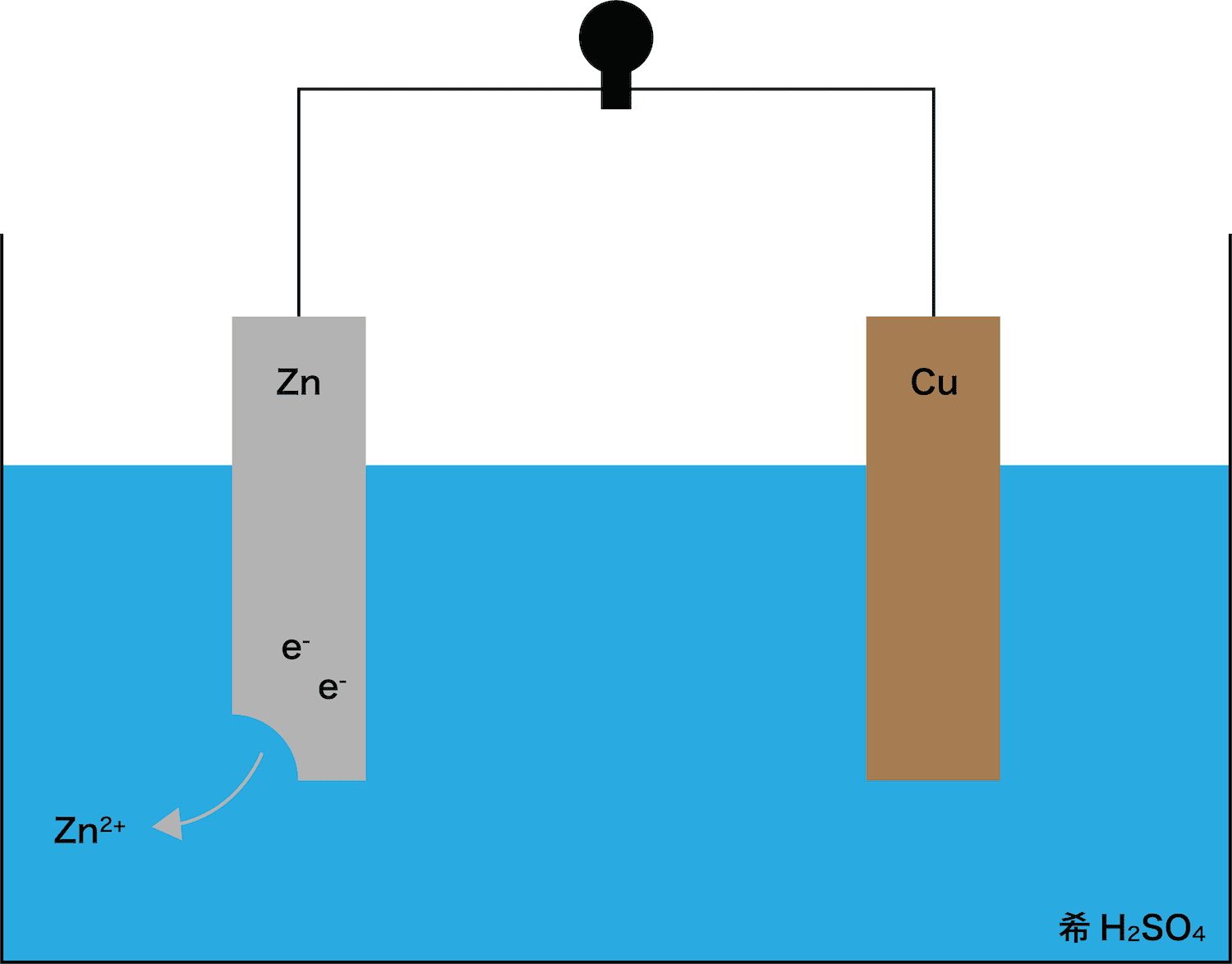
ボルタ電池とは、亜鉛Zn板(負極)と銅Cu板(正極)を希硫酸H2SO4に浸した電池である。
ボルタ電池は、イタリア人であるボルタが1800年に発明した電池が原形になっている。
ボルタ電池の電池式
上述の通り、ボルタ電池とは、亜鉛Zn板(負極)と銅Cu板(正極)を希硫酸H2SO4に浸した電池である。
これを踏まえて、ボルタ電池の電池式は次のように表すことができる。
(-)Zn|H_{2}SO_{4}aq|Cu(+)
\]
ボルタ電池の仕組み
| STEP1 | イオン化傾向の大きい金属板が溶ける |
| STEP2 | STEP1で発生した電子e–がもう片方の金属板の方へ流れる |
| STEP3 | 流れてきたe–が(溶液中の)イオン化傾向の小さい陽イオンとくっつく |
ボルタ電池の仕組みについて、上の3STEPを用いて解説する。
STEP1
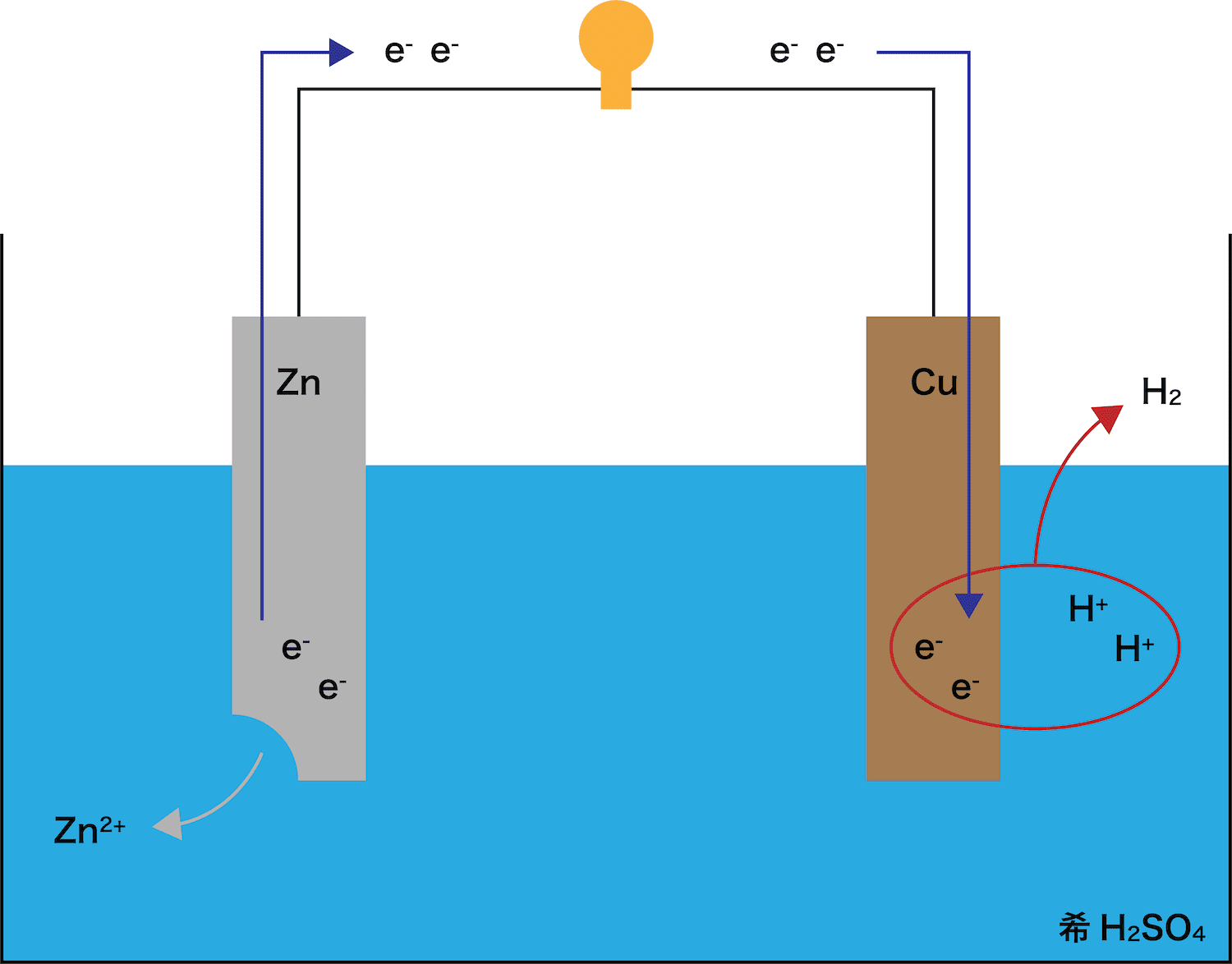
まずは、イオン化傾向の大きい金属板が溶ける。(詳しくはイオン化傾向(覚え方・定義・金属板の反応のしやすさ)を参照)
ボルタ電池に使われている金属板はCuとZnであり、これらのうちイオン化傾向がより高いのはZnである。したがって、Zn板が溶け出す。
また、ZnがZn2+という陽イオンになったので、電子e–が発生していることも確認しておこう。
STEP2

STEP1で発生した電子e–がCu板側に伝わる。
このとき、電子e–が通過することで(電流が発生して)豆電球が点灯していることに注目しよう。
STEP3

Cu板に流れてきた電子e–は、希H2SO4中に存在しているH+とくっつく。(=気体のH2発生)
各極の反応
ボルタ電池の負極・正極での反応をそれぞれまとめておこう。
負極
ボルタ電池の負極では、Zn板が溶け出してZn2+とe–が発生する。
Zn→Zn^{2+}+2e^{-}
\]
正極
ボルタ電池の正極では、H2SO4中に存在しているH+がe–を受け取ることでH2が発生する。
2H^{+}+2e^{-}→H_{2}
\]
ボルタ電池の問題点
ボルタ電池では、正極で気体の水素(H2)を発生する。
ボルタ電池を使い続けるとこのH2がCu板の周りに溜まってくる。
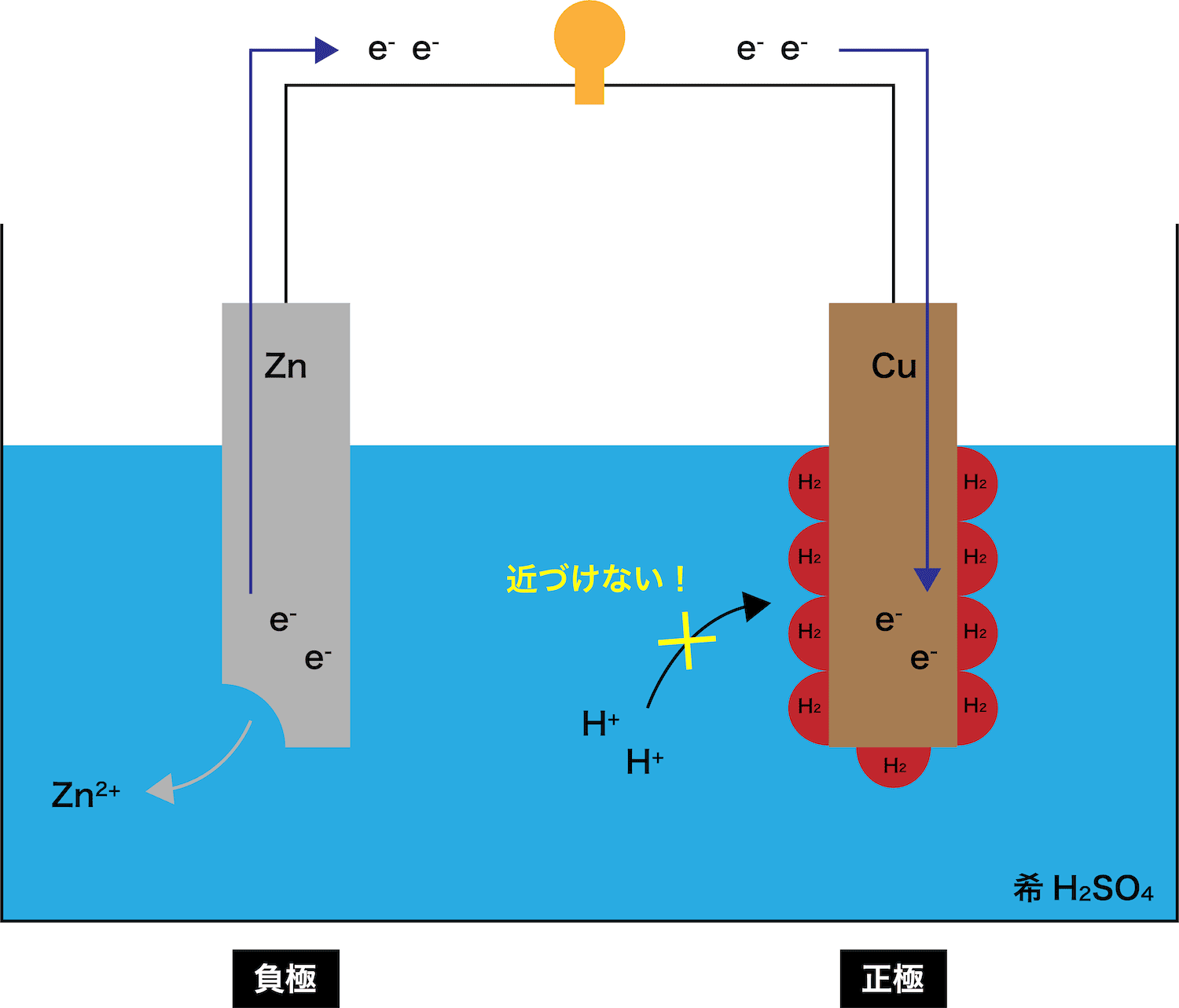
溜まったH2は、水溶液中のH+が負極からやってきたeーを受け取るのを妨害してしまう。
その結果、電子の受け渡しに不具合が生じ、電圧が急激に低下する分極という現象が起こる。
分極を防ぐためには、H2O2などの減極剤を溶液に加える必要がある。
ボルタ電池に関する演習問題
問1
ボルタ電池の負極は【1】板、正極は【2】板である。
問2
ボルタ電池では、まずイオン化傾向のより【1(大きor小さ)】い亜鉛板が溶け出し【2】となる。
このとき放出された【3】は銅板側に伝わる。
銅板側で【3】は希H2SO4中の【4】が受け取って【5】が発生する。
ボルタ電池の放電では、正極で発生する【1】が原因で起電力が低下する。
その結果、電子の受け渡しに不具合が生じ、電圧が急激に低下する【2】という現象が起こる。【2】を防ぐためにはH2O2などの【3】を溶液に加える必要がある。







