ファンデルワールス力(相互作用)の分類
ファンデルワールス力(ファンデルワールス相互作用)は大きく3種類に分けることができる。
双極子-双極子相互作用
まずは、双極子の定義を確認する。
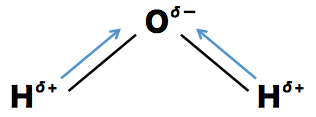
分子内に電気陰性度が異なる原子同士が結合している箇所があると、その部分には僅かな”電荷の偏り”が生じている。例えば、水素原子Hと酸素原子O間の結合の場合Hと比べてOの方が電気陰性度が高いのでO原子が結合に使われている電子を引きつけて電荷がややマイナスに偏っている。反対に、電子を引っ張られたのでH原子の方は電荷がややプラスに偏る。正電荷と負電荷の偏りが近い場所で存在している状態を分極といい、分子内で分極している分子を双極子という。
双極子と双極子が近くに存在すると、お互いに引き合って(結合とまでは言えないくらいの)弱いつながりを形成する。

これを双極子-双極子相互作用(または配向効果)といい、ファンデルワールス相互作用の一種だと考えられている。
また、”イオン”も(原子間の電気陰性度の差によって電荷の偏りがあるわけではないが)原子上に電荷の偏りが生じているので双極子と相互作用によって引き合う場合がある。このときは、イオンと双極子の相互作用であるので「イオン-双極子相互作用」という(この相互作用はイオンが関わるのであくまで”静電相互作用”の一種であり双極子-双極子相互作用を含むファンデルワールス相互作用には含まれない)。一般に、イオンは双極子に比べ電荷の偏りが大きいので「イオン-双極子相互作用は双極子-双極子相互作用よりも分子を結合させる力が強い」と考えられている。
双極子-誘起双極子相互作用
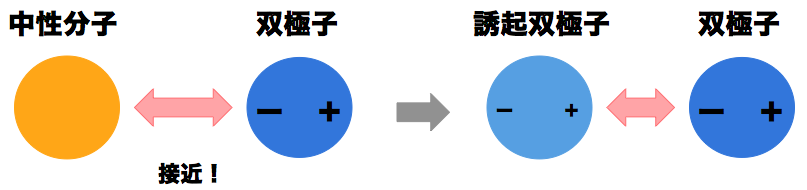
双極子を電荷の偏りがない分子(=中性分子)に近づけると、中性分子中の電子分布が歪み瞬間的な電荷の偏りが生じる場合がある。この時できた電荷の偏りを持つ分子を誘起双極子と呼び、誘起双極子は双極子と双極子-誘起双極子相互作用を起こす。
誘起双極子-誘起双極子相互作用
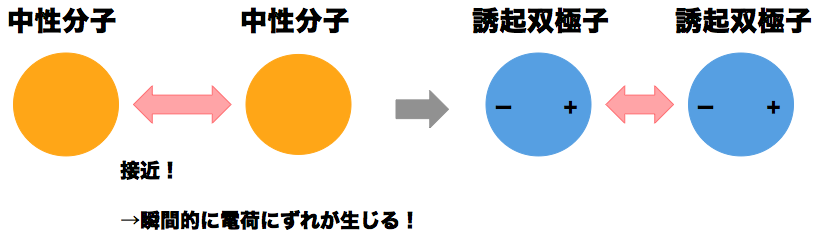
誘起双極子が生じた時にその近くにいる中性分子がその誘起双極子によって誘起され新たな誘起双極子が生じる場合がある。この時、元からある誘起双極子と新たに生じた誘起双極子の間に相互作用が生じることがあり、この相互作用を誘起双極子-誘起双極子相互作用(=分散力・ロンドン力)と呼ぶ。
水素結合
水素結合は今上でやったファンデルワールス相互作用「双極子-双極子相互作用」の一種だと考えることができる。
高校化学で「水素結合は電気陰性度の高い元素(F/O/N)に付いた水素とF/O/N間の結合である」と習ったはずである。

この時、F/O/N原子に結合した水素原子はF/O/N原子に結合電子を引っ張られることで正に帯電している。分子内で電荷の偏りが生じているということは、その分子は双極子であると考えられる。従って、双極子と双極子による相互作用(≒結合)なので水素結合は双極子-双極子相互作用の一種であると判断できるわけである。
水素結合はDNAの二重らせん構造やタンパク質の2次構造であるα-ヘリックス構造・β-シート構造の形成に役立っており、生体内でも重要な働きをしている結合であると言える。
ポテンシャルエネルギーと分子間距離
最初に述べたように、ファンデルワール力とは「双極子-双極子相互作用・双極子-誘起双極子相互作用・誘起双極子-誘起双極子相互作用」の総称である。
これらの相互作用を示す分子(つまり双極子や誘起双極子)同士は、引き合うこともあるがその距離によっては反発を起こす可能性もあり、引力と反発力のバランスのとれたところが一番安定している。
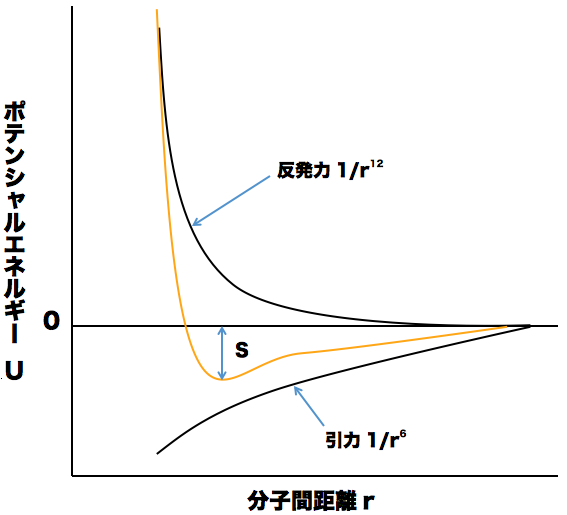
これはレナード・ジョーンズ・ポテンシャルのグラフである。
2つの分子(双極子)の距離をrとすると、引力はr6に反比例するので1/r6、反発力はr12に反比例するので1/r12と表すことができる。
図のオレンジ線は引力と反発力のエネルギーを足し合わせた「分子のポテンシャルエネルギー」を表している。分子間距離rが小さすぎると、ポテンシャルエネルギーが非常に大きく不安定な状態である。分子間の距離rが大きくなるにつれ徐々にポテンシャルエネルギーが低くなり、最も低くなったSの地点が一番安定していて分子間相互作用が強くなっている。また、分子間距離が大きくなり過ぎるとポテンシャルエネルギーの値が再び上昇してしまい不安定な状態となる。
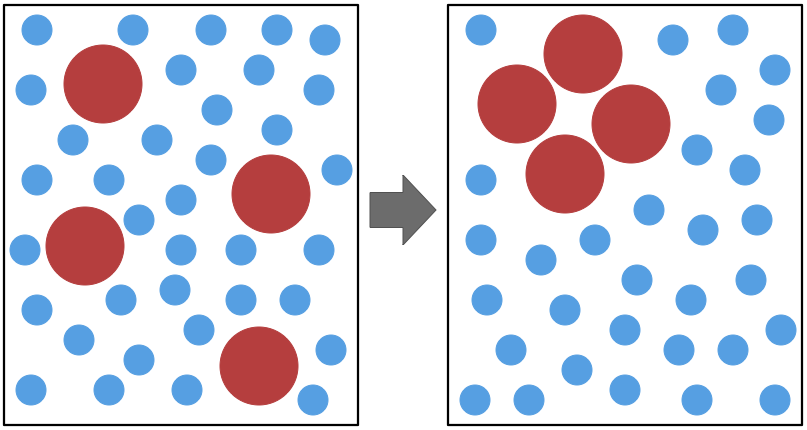
疎水性相互作用
水分子同士は水素結合により繋がれているが、疎水性分子が水分子の間に入るとこれを切断してしまう。その結果、水素結合のネットワークが崩れて自由度(乱雑さ)が落ち、水分子のエントロピーが減少してしまう。「エントロピー・エンタルピー」に書いてあるように、エンタルピーは通常増加する方向に働くので、水分子は仲間同士で近くに集まってエントロピーの減少を最小限に押さえようとする。その結果、疎水性分子同士は近い場所に固まることになる。このような、外的要因による疎水分子の相互作用のことを疎水性相互作用という。