理想気体は「気体自身の体積がない」という実際にはあり得ない条件をもつ気体であり、その条件の元に作られたのが理想気体の状態方程式「PV=nRT」であった。
従って、この方程式を実在する気体に適用することはできない。
実在する気体分子は、体積Vの容器内を自由に動き回ることはできないため気体分子自身が持つ排除体積b(気体自身が占有すると体積)と物質量nとの積をVから差し引いて考える必要がある。
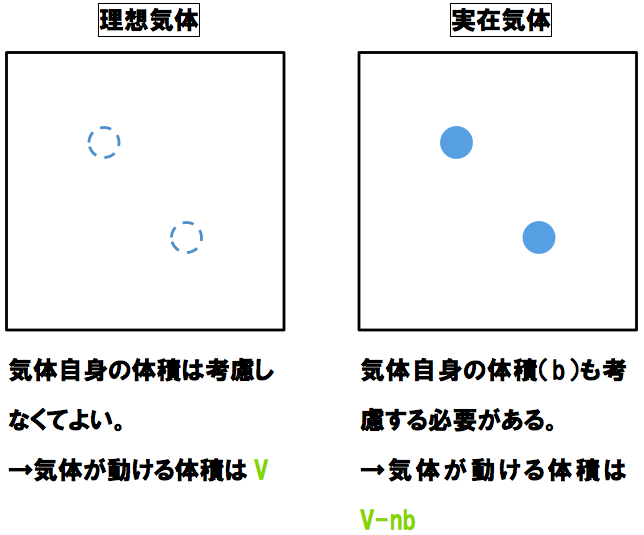
この実在気体が動くことのできる体積Vーnbを理想気体の状態方程式のVに当てはめると…
P(Vーnb)=nRT
となる。
また、理想気体では「分子間相互作用」を無視することができたが、実在気体を考える際はこれについても考える必要がある。
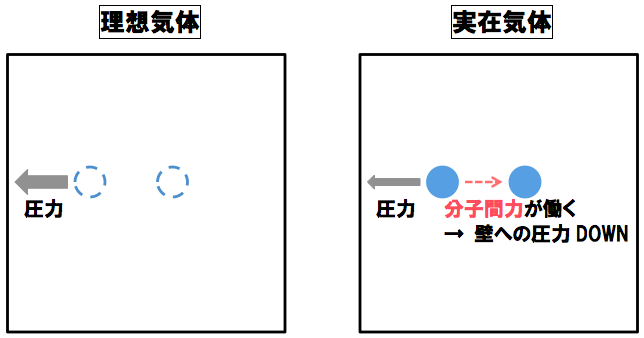
気体分子に分子間相互作用(分子間力)が働くと、その分だけ容器に対しての圧力が弱まる。
従って、実在気体の圧力Pに分子間相互作用による圧力の低下分を加えると理想気体の圧力と同じ値になるはずである。
分子間力の大きさを示す定数をaとし、これが気体のモル濃度(n/V)の二乗に比例することを考慮すると…
(p+an2/v2)(Vーnb)=nRT
この式が実在気体の状態方程式(ファンデルワールスの式)である。






