目次
膜透過と薬物の形
POINT膜透過と薬物
分子形薬物 → 膜透過できる!
イオン形薬物 → 膜透過できない!
イオン形薬物 → 膜透過できない!
分子形薬物は膜を透過することができるが、イオン形薬物はできない。
このことを踏まえてpH変化と酸性・塩基性薬物について考えていく。
pH変化と酸性薬物
POINT
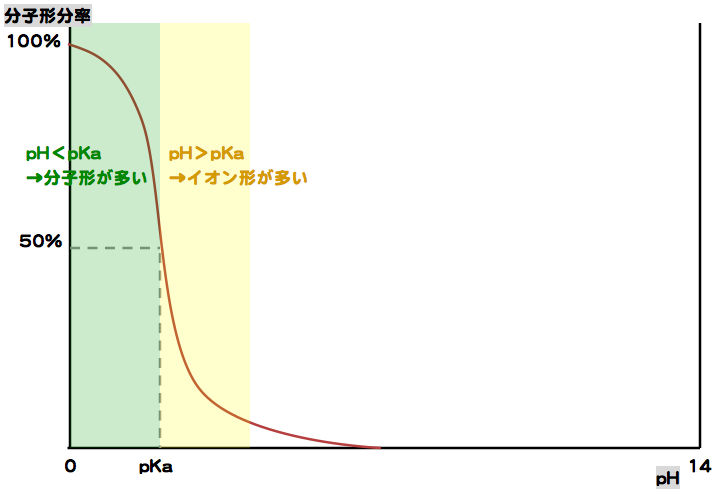
pH> pKa → イオン形が主
pH < pKa → 分子形が主
pH < pKa → 分子形が主
酸性薬物では、pH > pKaのときイオン形が多くなり、pH < pKaのとき分子形が多くなる。
pKaとは
酸解離定数を表し、溶液中での分子形薬物濃度が50%となる時のpHのことである。pKaが低いほど酸として強い。
また、pKaの異なる酸性薬物のグラフを組み合わせると次のようになる。
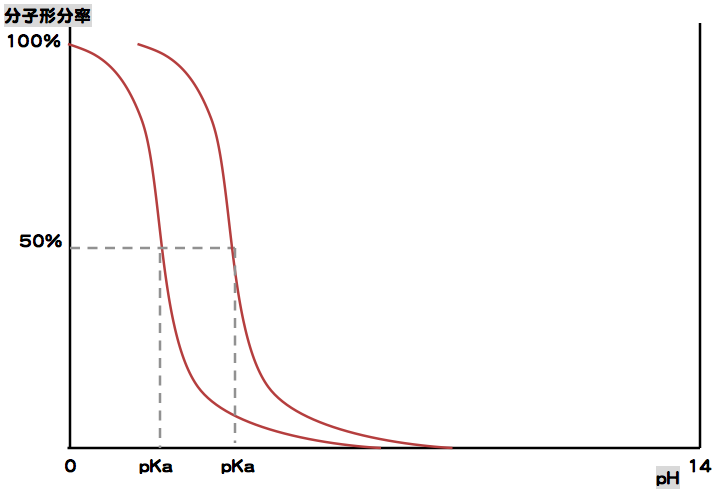
グラフを見てわかるように、pKaの大きい薬物の方が分子形が存在する割合が大きくなるので、効率よく吸収できる。(分子量が同程度の場合)
pH変化と塩基性薬物
POINT
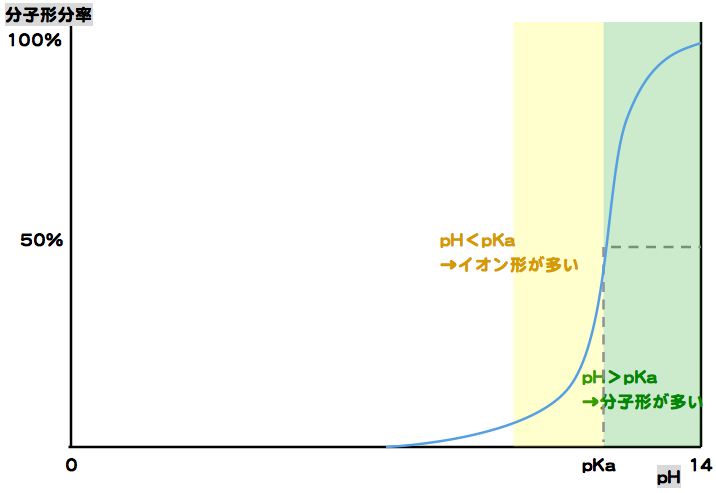
pH > pKa → 分子形形が主
pH < pKa → イオン形が主
pH < pKa → イオン形が主
塩基性薬物では、pH > pKaのとき分子形が多くなり、pH < pKaのときイオン形が多くなる。
また、pKaが異なる2つの塩基性薬物のグラフを組み合わせると以下のようになる。
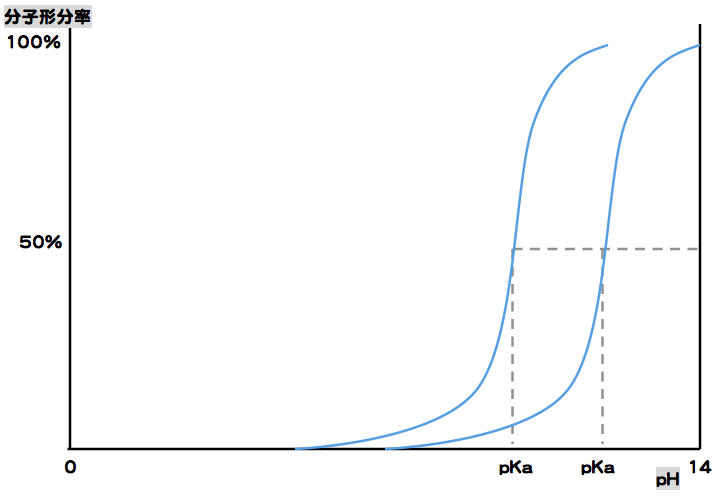
グラフから、pKaが小さい方が分子形の割合が多くなり、従って吸収もいいということが判断できる。
pH分配仮説とヘンダーソン・ハッセルバルヒの式
POINT

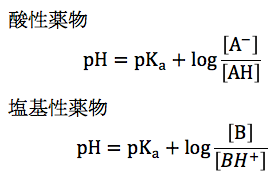
薬物のpH・pKa・分子形/イオン形比の関係は、上の式で表すことができる。
実際にこの式を用いて以下の問題を解いてみる。
例題
アスピリン(pKa=3.5)が胃の中で溶けるか溶けないか判断せよ。ただし、胃内のpHは1.5とする。
アスピリンは酸性薬物なので、pH=pKa+log([A–]/[HA])に値を当てはめる。
pH=pKa + log([A–]/[HA])
1.5 = 3.5 + log([A–]/[HA])
log([A–]/[HA])= -2.0 = log10-2.0
[A–]/[HA]= 10-2.0 = 1/100
[A–]:[HA]= 1:100
1.5 = 3.5 + log([A–]/[HA])
log([A–]/[HA])= -2.0 = log10-2.0
[A–]/[HA]= 10-2.0 = 1/100
[A–]:[HA]= 1:100
以上より、アスピリンは胃内でほとんどが分子形として存在しているので、溶けにくいと判断できる。




