目次
共鳴とは
共鳴とは、結合に使われている電子や分子を構成する原子が持つ電荷がπ結合を介して分散することである。
以下は炭酸イオンが共鳴した際の構造式である。

ここで、共鳴を考える上で重要なポイントを幾つか挙げておく。
POINT共鳴に関する重要事項
・電子の位置は変化するが原子の位置は変わらない
・電子が移動してもオクテット則は満たされる
・共鳴構造は共存する
・電子が移動してもオクテット則は満たされる
・共鳴構造は共存する
共鳴構造では電子の位置のみが変化し、原子の順番が変わったりはしない。また、どの共鳴構造体でも基本的にオクテット則は満たされるようになっている。(オクテット則について詳しくはオクテット則・構成原理・パウリの排他原理・フンドの規則を参照)
共鳴と酸性度
共鳴により共役塩基が安定化されると、酸性度は高くなる。
以下は、酢酸の共鳴の図である。
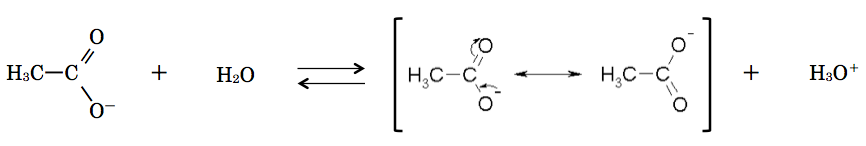
共鳴した結果、酢酸の酸性度は共鳴をすることのできないエタノールなどと比べて高くなっている。
共鳴と塩基性度
共鳴により電子が非局在化されると、置換基上の電子密度が低下し、結果として塩基性が低下する。
以下は、アニリンの共鳴の図である。
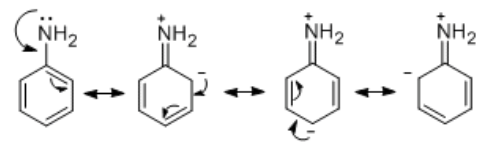
共鳴した結果、アニリンの置換基であるNH2上の電子密度が下がるため、塩基性度は(共鳴をしないものと比べ)低くなっている。




