オクテット則
オクテット則とは、「原子は最外殻を満たすように、または最外殻電子が8コ(希ガスと同じ配列)になるように、電子を与えたり受け取ったり共有したりする」という理論のことである。
例えば、リチウムは2s軌道に1コの電子を有している。もしこの電子を失えば、リチウムは完全に満たされた最外殻(1s軌道)を持つことになる。これは最も安定な形であり、従ってリチウムは容易に電子を離し一価の陽イオンになることが理解できる。また、ナトリウムについても同様に考えることができる。ナトリウムは3s軌道に1コの電子を有している。もしこの電子を失うと完全に満たされた最外殻(2p軌道)を持つことになる。従ってナトリウムは容易に電子を離し一価の陽イオンとなる。
構成原理
構成原理は“積み上げ原理”とも呼ばれ、「電子は常にエネルギーの低い、空いている軌道を優先して占有する」という理論である。
例えば、1s軌道は2s軌道と比較して原子核に近いためエネルギーが低くなっている。従って、2つの軌道が空いていると1s軌道の方に優先して電子が入ることになる。ちなみに軌道のエネルギーの大きさは次の順になっている。
パウリの排他原理
② その2コは反対向きのスピンを持つ
パウリの排他原理とは、「①各原子軌道を占有できる電子の数は2コまであり、②その2コは反対向きのスピンを持つ」という理論のことである。排他的という名前が付いているのは、限られた数の電子のみが殻を占有できるからである。
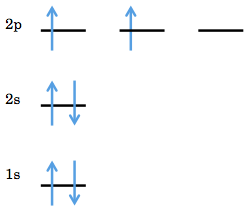
フンドの規則
フンドの規則とは、「同じエネルギーを持つ2つの縮重した軌道があるとき、電子は他の電子と対を作る前に空いている軌道を占有する」という理論である。これは、こうした電子配置をとった結果電子間の反発を出来るだけ抑えることができるからである。
例えば、炭素原子が持つ電子のうち2p軌道に入る2つは、1つの2p軌道に両方入るのではなく、それぞれ異なる2p軌道に入っていく。