MENU
はじめに
原子の構造とそこで出てくる各種用語(陽子・中性子・電子・原子核・質量数・原子番号など)は高校化学を学ぶ上で絶対に必要となる知識。この機会にしっかり押さえて、周りの受験生に置いていかれないようにしよう!
原子とは
原子とはボクたちの身の周りの物すべてを構成している小さくて丸いツブである。ボクたち人間も、飼っているペットも、いまいじっているパソコンやスマホも、全部この原子からできている。
現在確認されてる原子の種類は118種類で、そのうち自然界を構成しているのは92種類である。ちなみに、原子にはそれぞれ番号がつけられていて、その番号を原子番号ということは覚えておこう。
原子核・電子
それでは、原子の中身を詳しく見ていこう。下の図全体が原子を表している。
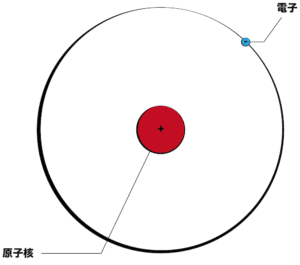
原子の中心にいる赤いマルを原子核、原子核の周りをグルグルまわっている青いマルを電子という。原子核はプラスの電荷を、電子はマイナスの電荷を帯びている。
陽子・中性子
次に、原子核の中身を詳しく見ていこう。まず覚えてほしいのは「原子核は陽子と中性子から成り立っている」ということである。
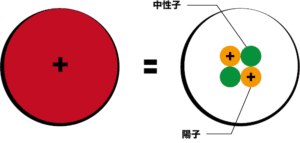
オレンジ色のマルが陽子、緑色のマルが中性子を表している。
ちなみに、陽子はプラスの電荷を帯びており中性子は電荷を帯びていない。これが、先ほど「原子核(陽子+中性子)はプラスの電荷を帯びている」と述べた理由である。
原子のサイズ
原子の直径は約10-8cm(1cmの1億分の1)である。対して原子核の大きさは、約10-13〜10-12cmなので、原子の大きさの10万分の1〜1万分の1しかない。これは、1円玉(原子核)と甲子園球場(原子)の大きさの関係に相当する。

陽子/中性子/電子の重さ
陽子・中性子・電子の重さは次の通り。陽子・中性子と比較して電子は極めて軽いことがわかるね。
| 質量(g) | 質量比 | |
|---|---|---|
| 陽子 | 1.673×10-24 | 1 |
| 中性子 | 1.675×10-24 | 1 |
| 電子 | 9.109×10-28 | 1/1840 |
原子番号(原子の化学的性質)
原子の化学的な性質(反応性など)を決める要素はなんだろうか。化学では電子に注目することが多い(化学結合や酸化還元など)ため「電子」と答えたくなるかもしれないが、実はその電子の数を決めているのは「陽子」なんだ。
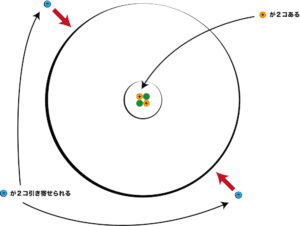
この原子の場合、陽子(プラス)が2コあるので、電子(マイナス)が2コ引き寄せられる。
このように、原子の化学的な性質を決めるのは陽子なので、陽子の数をその原子の番号(原子番号)とする。
質量数(原子の物理的性質)
原子の物理的な性質(運動性など)を決める要素は「重さ」である。前ページに表で示したように、原子を構成する3つのパーツの質量比は次のようになっている。
\mathtt{ 陽子:中性子:電車=1:1: \frac{ 1 }{ 1840 } }
\]
電子の質量は陽子、中性子と比較して極めて小さい。したがって、「原子の重さ≒陽子の重さ+中性子の重さ」と考えることができる。
では、次の原子の重さは一体どのくらいになるだろうか。
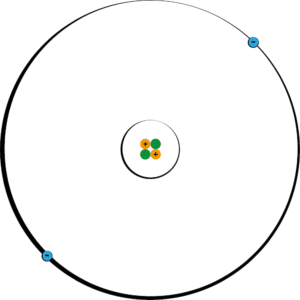
(前ページの表より)陽子1コの重さが1.673×10-24、中性子1コの重さが1.675×10-24なので…
\mathtt{ (1.673×10^{-24}×2 + 1.675×10^{-24}×2) g }
\]
この数字はとても小さいのでイメージしにくい。そこで、原子の重さを、本当の質量ではなく「陽子と中性子の合計粒子数」で表す。
\mathtt{ \underbrace{ 2 }
_{ 陽子} +
\underbrace{ 2 }
_{ 中性子 } = 4}
\]
この「陽子と中性子の合計粒子数」は原子の質量の代わりになる数値なので、質量数と呼ぶ。
原子に関する公式たち
| NO.1 | 原子番号=陽子の数 |
| NO.2 | 陽子の数=電子の数 |
| NO.3 | 陽子の数+中性子の数=質量数 |
ここまで紹介してきたことを公式としてまとめておこう。陽子が原子の化学的な性質を決定するので原子番号は陽子の数と等しい。1コの陽子が1コの電子を引き寄せるので原子に含まれる陽子の数と電子の数は等しい。原子の重さを表す質量数は(極端に軽い電子は省くので)陽子の数と中性子の数を足した値となる。
原子の表記法
原子は元素記号という1〜2文字のアルファベットで表される。元素記号の左上に質量数、左下に原子番号を書く。

この表記を見て陽子の数・電子の数・中性子の数を言えるようにしておこう。
原子番号=陽子の数なので、陽子の数は6コ
陽子の数=電子の数なので、電子の数も6コ
陽子の数+中性子の数=質量数なので、中性子の数も6コ
となる。
応用:中間子と核力
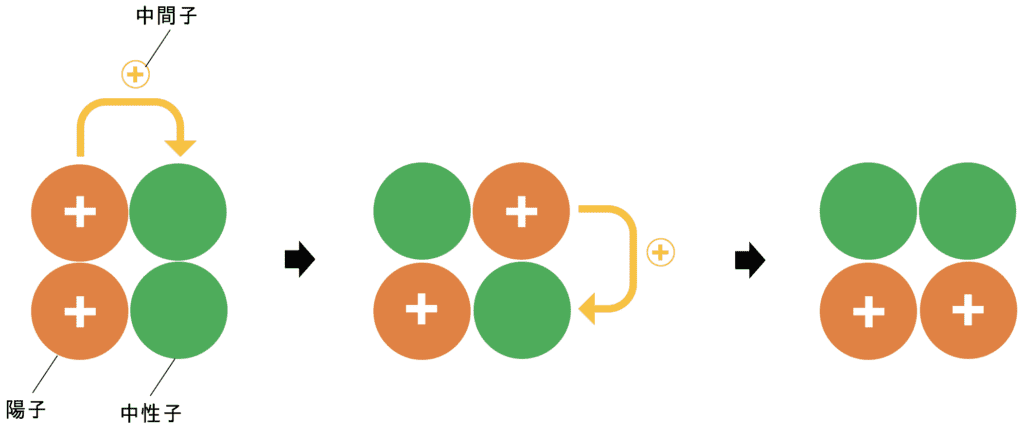
ヘリウム(原子番号2)以降の原子は陽子を複数個持つため、原子核に陽子しかない場合プラス同士の電気的な反発が起こる。これを避けるために中性子が存在している。
陽子と中性子は「中間子」と呼ばれる素粒子を素早く交換しながら結びついている。つまり、陽子が中間子を放出し、中性子がこれを受け取ると、陽子は中性子に、中性子は陽子に変化する。これを繰り返すことで中間子によって陽子の正電荷が絶えず運び続けられる。結果、陽子と中間子の間には(陽子同士の反発を無力化するほどの)強い相互作用(=核力)が働くため原子核は安定して存在できる。
演習問題
蒸留の注意点(入試頻出ポイント)
| NO.1 | 枝付きフラスコに入れる溶液の量は1/2以下にする |
| NO.2 | 枝付きフラスコを加熱する際は金網を敷く (水浴の場合もあり) |
| NO.3 | 枝付きフラスコを加熱する際は沸騰石を入れる |
| NO.4 | 温度計は枝付きフラスコの枝元に来るようにする |
| NO.5 | リービッヒ冷却器を通す冷却水は「下から上」に流す |
| NO.6 | アダプターと受け器は密閉しない |
| NO.7 | 蒸留の始めと終わりに出る液体は捨てる |
枝付きフラスコに入れる溶液に量は1/2以下にする。これは、溶液を入れすぎると沸騰した時に液が枝側に入りリービッヒ冷却器の方に行ってしまうためである。
枝付きフラスコを直接加熱するとフラスコが破損する可能性があるため、枝付きフラスコを加熱する際は金網を敷かなければいけない。
金網以外では、水を溜めた水浴に枝付きフラスコを浸けて加熱したり、水浴で加熱できない沸点が100℃以上の溶液は(水は100℃以上に加熱できないため)油浴や砂浴を使ったり、といった場合もある。
また、加熱する際は”沸騰石”と呼ばれる石を入れる必要がある。これは突沸(液体が沸点になっても沸騰せず、わずかに刺激を与えた時に急激に沸騰する現象:溶液が噴き出したり容器が破損する恐れがある)を防ぐためである。(突沸について詳しくは【理由】なぜ突沸が起こるのか?原理と対処法を公開!を参照)
発生した蒸気の温度を測るため枝付きフラスコに温度計を設置する必要があるが、この時温度計の球部は「フラスコの枝元」にする必要がある。溶液につけたりすると溶液の温度を測っていることになってしまうので、当然と言えば当然である。
リービッヒ冷却器に通す冷却水は「下から上」に流すようにする。上から下に流すと水が溜まりづらく冷却効率が悪くなってしまう。
アダプターと受け器は密閉してはならない。アダプターと受け皿をゴム栓やガラス栓で密閉して蒸留すると装置内の圧力が上がり器具を破損する可能性がある。(ただし、外部から異物が混入するといけないのでアルミホイル等を被せて受け器の口を軽く塞ぐ必要がある)
蒸留の始めの液と終わりの液は捨てる必要がある。これは、始めの液と終わりの液は不純物を含む可能性が高いためである。
12.0 × \frac{ 98.9 }{ 100 } + 13.0 × \frac{ 1.1 }{ 100 } \\
= 12.0 × \frac{ 98.9 }{ 100 } + (12.0+1.00) × \frac{ 1.1 }{ 100 } \\
= 12.0 × \frac{ 98.9 }{ 100 } + 12.0 × \frac{ 1.1 }{ 100 } + 1.00 × \frac{ 1.1 }{ 100 }111111111111111111111111111\\
= 12.0 × (\frac{ 98.9 }{ 100 } + \frac{ 1.1 }{ 100 }) + 1.00 × \frac{ 1.1 }{ 100 }\\
= 12.0 × 1 + 1.00 × \frac{ 1.1 }{ 100 }\\
= 12.0 + 0.011\\
= 12.011
\]