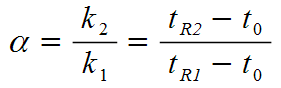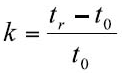第101回薬剤師国家試験 問1〜問10
1 HF
2 HCl
3 HI
4 H2O
5 H2S
- 問1:解答・解説
-
解答:4POINT
沸点大 = 分子量大基本的に、分子量が大きいほど沸点は高くなる。
また、同じくらいの分子量だと水素結合などの分子間力が働いている分子の方が沸点が高くなる。
H2Oは、水素結合を形成するために必要な水素原子Hを分子中に2つも持っており、かつHとOの電気陰性度の差が大きいので今回の答えは4であると考えることができる。
なお、水の沸点・融点は(分子量の割に)非常に高いということは例外的に覚えておいてもいいでしょう。
1 活性化エネルギー
2 活性化自由エネルギー
3 活性化エンタルピー
4 活性化エントロピー
5 反応熱
- 問2:解答・解説
-
解答:5
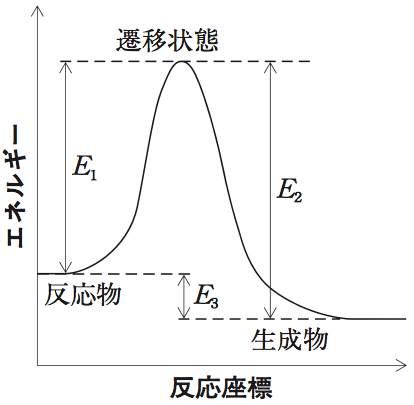
生成物と反応物のエネルギー差(E3)を表す言葉は反応熱(反応エンタルピー)である。
ちなみに、E1は発熱反応が起こった時の活性化エネルギーを、E2は吸熱反応が起こった時の活性化エネルギーを表している。
1 ギブズ自由エネルギー(G)
2 エンタルピー(H)
3 圧力(P)
4 エントロピー(S)
5 内部エネルギー(U)
- 問3:解答・解説
-
解答:3
示強性とは「同一条件の複数の系を合わせて1つにしたり、単一の系を分割してその内の1つの系に注目した時に値が変化しない性質」のことである。例としては「温度が50℃の水と50℃の水を合わせても(100℃にはならず)50℃である」などが挙げられる。
示強性を示す熱力学的パラメーターとして有名なのは、温度・圧力・化学ポテンシャル・濃度・密度などである。反対に、系を合わせると値が加減方式で変化するパラメーターのことは示量性状態関数と呼び、体積・物質量・エンタルピー・エントロピー・ギブス自由エネルギー・内部エネルギーなどが当てはまる。
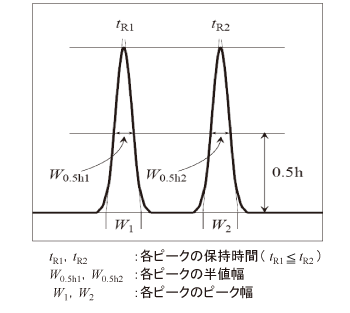
クロマトグラフィーで用いられるパラメータのうち、クロマトグラム上のピーク相互の保持時間の関係を示す値はどれか。1つ選べ。
1 分離係数
2 シンメトリー係数
3 保持容量
4 理論段数
5 理論段高さ
- 問4:解答・解説
-
解答:1分離係数とは、複数の試料がある時のtR -t0の比のことである。
式で表すと、以下の通りである。

ちなみに、式中のkは保持係数のことであり、以下の式で表される。

1 アボガドロ定数
2 ファラデー定数
3 プランク定数
4 ボルツマン定数
5 リュードベリ定数
- 問5:解答・解説
-
解答:2
pHメーターは「ガラス電極を間に挟んだ2つの溶液の電位差」を利用してpHを測定する。
電位差に関係している定数は選択肢の中でファラデー定数のみなので、これが答えである。
(ファラデー定数(F)とは電子の物質量あたりの電荷を表す定数であり、約 1F = 9.6485309×104C/molで表すことができる)アボガドロ定数とは1molあたりに含まれる粒子数を表すものであり、約6.0 × 1023 (/mol)である。
原子の個数や物質量について考えるときに出てくる数なので、今回の問題とは無関係。プランク定数hとは光子のもつエネルギーと振動数の比例関係をあらわす定数のことである。
主に量子論の話で出てくる定数であり、今回の問題とは無関係である。ε = hv
(ε:光子の持つエネルギー,v:振動数,h:プランク定数「h=6.6260755×10-34J・s」)ボルツマン定数(k)とは分子1個あたりの気体定数であり、気体定数をアボガドロ数で割った数と考えることもできる。
値としては、約1.379553×10-23J/Kである。
状態数とエントロピーを関係づける定数なので、今回の問題とは無関係である。リュードベリ定数(R)とは主に発光や吸収スペクトルを説明する際に用いられる定数であり、今回の問題とは無関係である。
値としては、約1.0973731.6×10-1である。
- 問6:解答・解説
-
解答:3
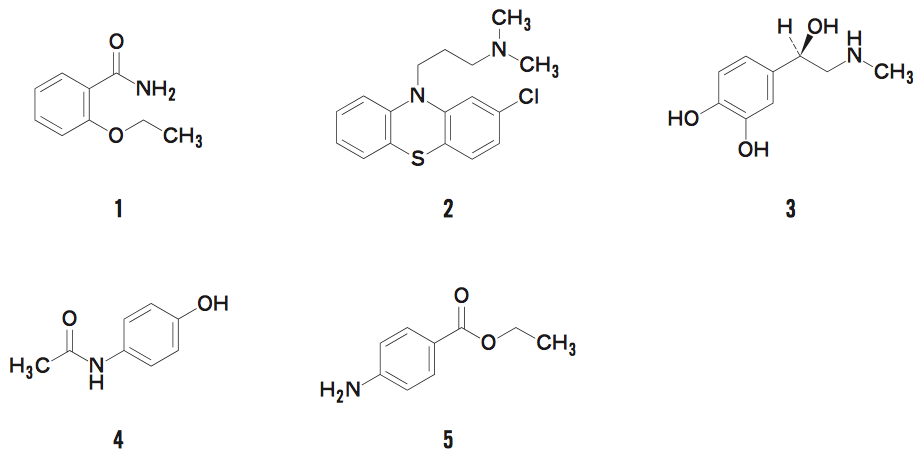
1は、エテンザミドである。
NSAIDsの一種で、解熱鎮痛剤である。
2は、クロルプロマジンである。
フェノチアジン系の統合失調治療薬である。
3は、アドレナリンである。
副腎髄質より分泌されるホルモンの一種であり、カテコールアミンに分類される。
4は、アセトアミノフェンである。
NSAIDsとは異なり抗炎症作用を(ほぼ)持たない解熱鎮痛剤である。
5は、ベンゾカインある。
麻酔薬として手術中の局所麻酔に用いられている。
1 CrO3
2 MnO2
3 K3[Fe(CN)6]
4 CuSO4
5 Ag2O
- 問7:解答・解説
-
解答:4
酸化数を決定する基本ルールは、以下の通りである。
POINT酸化数決定のルール ・単体原子の酸化数は0
・化合物全体の酸化数は0
・イオン全体の酸化数は、その電荷に等しい
・アルカリ金属=+1
・二族元素=+2
・ハロゲン=ー1
・H → +1
・O → -2(例外)H2O2 の場合は、O→-1とする。
・水素原子=+1
・酸素原子=ー2
・硫黄原子=ー2選択肢1は、O原子が3つで-6、分子全体で0になるはずなのでCrの酸化数は+6となる。
選択肢2は、O原子が2つで-4、分子全体で0になるはずなのでMnの酸化数は+4となる。
選択肢3は、K原子が3つで+3(+1×3)なので、残りの錯イオン([]で囲まれた部分)はー3になるはずである。従って、(錯イオン中のCN–は1つで−1なので6コで−6ということを考えると)Feの酸化数は+3となる。
選択肢4は、O原子が4つで-8、Cuが1つで+2となるので、残るS原子は−2である。
選択肢5は、O原子が1つで-2、分子全体で0になるはずなのでAgの酸化数は+1となる。
- 問8:解答・解説
-
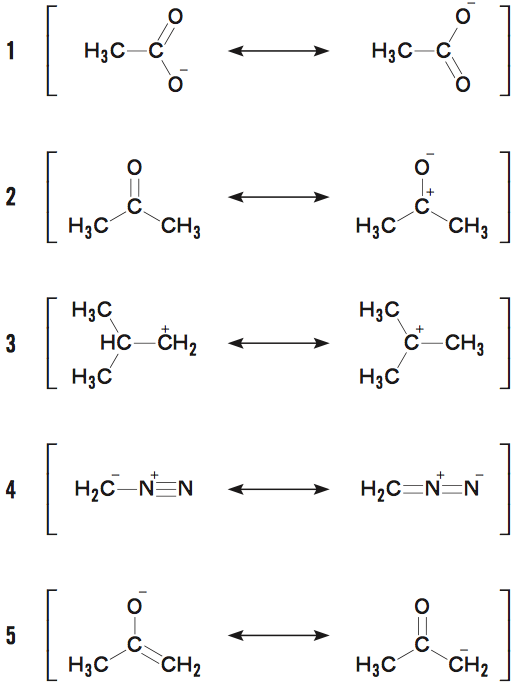
解答:3POINT
共鳴構造では、“電子の位置”のみ変化する共鳴構造式では、原子の位置は変化せず、電子の位置のみが変化する。
選択肢3は、H原子が移動しているため、共鳴構造式ではない。
- 問9:解答・解説
-
解答:1
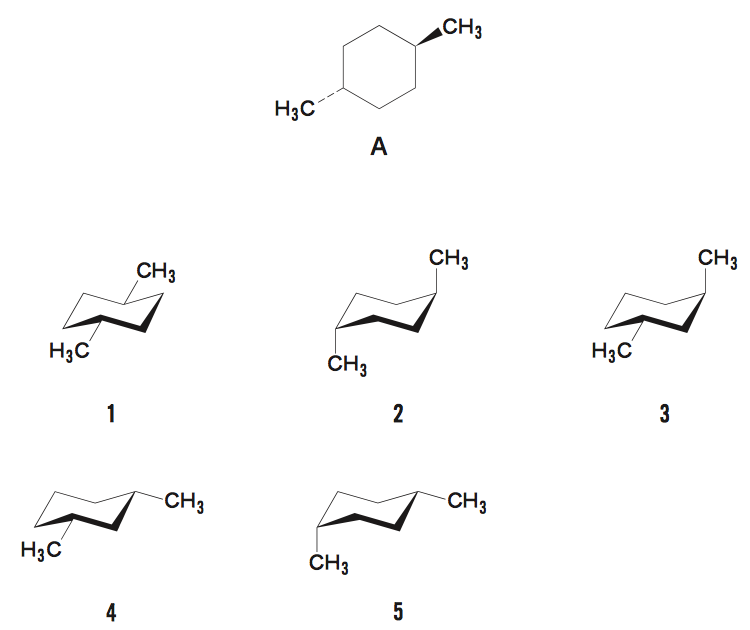
シクロヘキサンの置換物の安定性に関する問題である。
置換基が両方ともエクアトリア位にあるときが最も安定であるので正解は1である。ちなみに、選択肢2は両方ともアキシアル位、選択肢3,4,5 はエクアトリアル位とアキシアル位がともに1つずつ存在する。
1 CH3SH
2 CF3CO2H
3 CH3CO2H
4 C6H5OH(フェノール)
5 CF3CH2OH
- 問10:解答・解説
-
解答:2
官能基による分類を確認すると、1がチオール、2と3がカルボン酸、4がフェノール、5がアルコールである。
これらの中で一番酸性度が高いのはカルボン酸なので、正解は2か3に絞られる。
2と3では、Cに結合している原子がHがFかという違いがあるが、Fの方が強く電子を引っ張るため結果的にカルボニル基(COOH)からHが離れやすくなる。従って、正解は2となる。